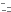Поляризационная микроскопия в гистологии
Поляризационная микроскопия — один из высокоэффективных методов морфологического исследования, обладающий широкими возможностями идентификации биологических структур, что в сочетании с доступностью и относительной простотой обусловливает его высокую ценность. Метод позволяет изучать не только гистологическое строение препарата, но и некоторые его гистохимические параметры. В 40 —50-х годах XX в. поляризационную микроскопию причисляли к ультраструктурным методам, так как она позволяла видеть ультраструктурные способности тканей.
Поляризационная микроскопия предназначена для изучения свойств гистологических структур, обладающих способностью двоякого лучепреломления (анизотропии) — раздвоения светового луча при прохождении его через анизотропную среду. Световая волна в анизотропной среде распадается на две волны с взаимно перпендикулярными плоскостями колебаний электромагнитных волн. Эти плоскости называются плоскостями поляризации. Поляризованный свет отличается от обычного (неполяризованного) тем, что в последнем колебания световых волн происходят в различных плоскостях, а в поляризованном свете — лишь в определенной плоскости.
Для создания эффекта поляризации в поляризационном микроскопе применяются два поляроида. Первый, который называется поляризатором, помещается между осветителем микроскопа и гистологическим препаратом.Второй поляроид, находящийся между гистологическим препаратом и глазом исследователя, — анализатором. И поляризатор, и анализатор в оптическом отношении представляют собой совершенно одинаковые поляризационные фильтры, поэтому их можно менять местами (если конструкция микроскопа это позволяет). Ранее для поляризационной микроскопии применяли изготавливаемые из исландского шпата призмы Николя, Аренса или Томсона. У этих призм был ограничен угол преломления света. В настоящее время вместо них используют плоские поляризационные фильтры, продуцирующие широкопольный поляризованный свет.
В создании поляризованного света определяющую роль играет взаимное расположение поляризатора и анализатора относительно оптической оси микроскопа. Если они ориентированы таким образом, что тот и другой пропускают поляризованный свет в одной и той же плоскости, т.е. при совпадении их плоскостей поляризации, оба поляризационных фильтра способны пропускать поляризованный свет; поле зрения микроскопа при этом светлое (рис. 1,а).
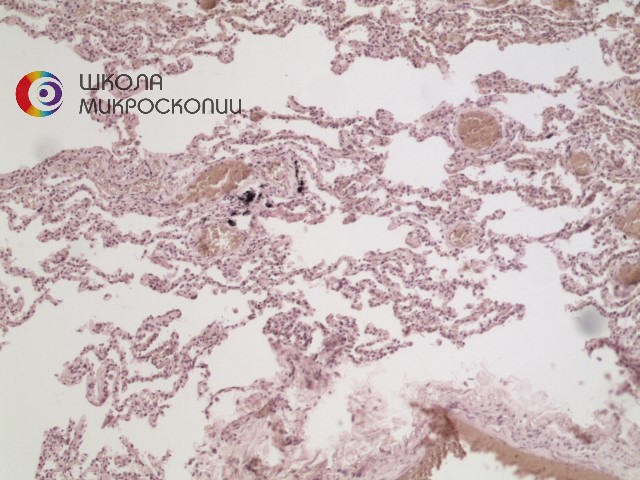
Рис. 1 Препарат легкого человека в светлом поле, OlympusCX41, объектив 10х
Если же плоскости поляризации поляризационных фильтров взаимно перпендикулярны (этого достигают путем поворота анализатора на 90° вокруг оптической оси микроскопа), то поляризованный свет не проходит и исследователь видит темное поле зрения (рис. 2). При повороте поляризатора на 360° в процессе его вращения поле зрения дважды полностью затемнено и дважды полностью просветлено. В прошлом применяли компенсаторные фильтры Бернауэра, при использовании которых затемненное поле зрения имеет красноватый оттенок (U-TP530). При применении черных зеркальных фильтров затемненное поле зрения выглядит не полностью темным, а слабо подсвеченным.

Рис.2 Препарат легкого человека в поляризованном свете, OlympusCX41, объектив 10х
В тех случаях, когда при скрещенном положении поляризационных фильтров (т.е. в ортоскопии) на пути поляризованного света встречаются анизотропные субстанции, содержащиеся в гистологическом препарате, эти субстанции расщепляют поляризованный свет на два луча с взаимно перпендикулярными плоскостями колебаний световых волн. Световые лучи с плоскостью колебаний, совпадающей с плоскостью поляризации, проходят через анализатор, а с перпендикулярной — отсекаются, вследствие чего интенсивность светового потока, попадающего в глаз исследователя и на камеру, составляет лишь половину интенсивности исходного светового пучка. В результате описанных процессов анизотропные субстанции, находящиеся между двумя скрещенными поляризаторами, видны на темном фоне в виде светлых светящихся объектов. При этом изотропные структуры, не обладающие способностью двоякого лучепреломления, остаются темными.
Это также влияет на выбор камеры для поляризационной микроскопии. Так как задача стоит снять небольшие светлые сигналы на темном фоне, то обычно камеры для светлопольной микроскопии может быть недостаточно, из-за низкой чувствительности камеры и большого количества шумов, которые образуются при съемке. Для съемки в поляризационной микроскопии необходима камера для микроскопии с высокой чувствительностью и точной цветопередачей. Предпочтительно использовать камеры на базе CCD- матриц (OlympusDP80, DP73, DP26,VideoZavr VZ-18C28, VZ-CC50S), однако на текущем этапе можно применять и бюджетные варианты камер на базе CMOS-матриц Sonyсерии IMX (VZ-18C23).
В биологических тканях имеется достаточное количество анизотропных структур: элементы сократительного аппарата мышц, амилоид, мочевая кислота, коллагеновые образования, некоторые липиды, ряд кристаллов и др.
Расщепленные в анизотропном объекте и проходящие через анализатор световые лучи характеризуются неодинаковой скоростью распространения волн. В зависимости от величины этой разницы (ее еще называют величиной задержки светового луча) и от различий абсорбции света в анализаторе свечение анизотропных объектов может быть белым или цветным. В последнем случае речь идет о феномене дихроизма (двойная абсорбция). Цветовые эффекты при исследовании в поле поляризации дают, например, многие кристаллы.
Процесс двоякого лучепреломления может быть усилен путем применения определенных красителей, молекулы которых обладают способностью ориентированно откладываться на анизотропных структурах. Гистохимические реакции, в результате которых возникает эффект анизотропии, называются топооптическими реакциями (G. Romhanyi). Различают две разновидности таких реакций — аддитивные и инверсивные. При аддитивных реакциях задержка светового луча увеличивается, что называют положительной анизотропией, при инверсивных реакциях она уменьшается — отрицательная анизотропия.
АППАРАТУРА И ОБОРУДОВАНИЕ
Поляризационную микроскопию проводят с помощью специальных поляризационных микроскопов. В качестве примера можно назвать импортные микроскопы Olympus BX53, Olympus BX43, Olympus CX41. Большинство современных оптических микроскопов оснащаются принадлежностями для поляризационной микроскопии.
Для поляризационной микроскопии можно приспособить любой световой микроскоп лабораторного и исследовательского класса. Достаточно иметь два поляризационных фильтра, один из которых, выполняющий функцию поляризатора, помещают между источником света и препаратом, а другой, играющий роль анализатора,— между препаратом и глазом исследователя. Поляризатор может быть встроен в конденсор или же размещен под ним над полевой диафрагмой, а анализатор — в слот револьвера или же промежуточную вставку.

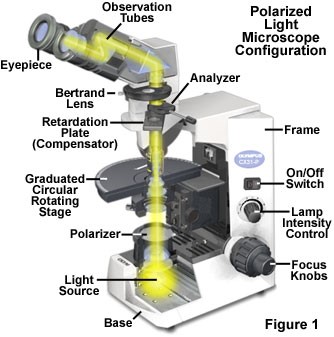
На рис. 3 представлена принципиальная схема поляризационного микроскопа. Помимо общих для всех световых микроскопов компонентов, в поляризационном микроскопе имеется два поляризационных фильтра (поляризатор, размещаемый обычно под конденсором, и анализатор, находящийся в окуляре), а также компенсатор. Анализатор должен обязательно вращаться, причем для определения степени вращения необходима соответствующая градуированная шкала.
В поляризационном микроскопе используется источник освещения, обеспечивающий высокую плотность светового пучка. В качестве такого источника рекомендуют применять лампу мощностью 100 Вт при напряжении 12 В. Для некоторых видов исследования требуется монохроматический свет. С этой целью используют металлический интерференционный фильтр, который лучше поместить над зеркалом [Scheuner G., Hutschenre-iter J., 1972]. Рассеивающее свет матовое стекло помещают перед поляризатором, т.е. между ним и источником освещения, но ни в коем случае не после поляризатора, так как при этом нарушается функция поляризационного фильтра.
Раньше для поляризационной микроскопии применялись ахроматические объективы без внутренних натяжений, однако сейчас они редкость. На сегодняшний день в поляризационном микроскопе используют только планахроматические объективы, которые не имеют внутренних натяжений. Апохроматические объективы можно применять лишь в тех случаях, когда требуется нормальная цветопередача при микрофотографировании [Appelt Н., 1955].
Поляризационные микроскопы оснащаются вращающимся предметным столиком, положение которого относительно оптической оси можно менять. Угол поворота столика измеряют с помощью градусной шкалы, нанесенной по его окружности. Одним из обязательных условий, обеспечивающих эффективное применение поляризационной микроскопии, является тщательная центровка вращающегося предметного столика с помощью центровочных винтов.
Важным элементом поляризационного микроскопа является компенсатор, помещаемый между объективом и анализатором, обычно в тубусе микроскопа. Компенсатор представляет собой пластинку, изготавливаемую из особых сортов гипса, кварца или слюды. Он позволяет измерять разницу хода расщепленных световых лучей, выражающуюся в нанометрах. Функционирование компенсатора обеспечивается его способностью изменять разницу хода световых лучей, низводя ее до нуля либо увеличивая до максимума. Это достигается вращением компенсатора вокруг оптической оси.
МЕТОДИКА МИКРОСКОПИИ В ПОЛЯРИЗОВАННОМ СВЕТЕ
Поляризационную микроскопию удобнее проводить в затемненном помещении, так как интенсивность светового потока, попадающего в глаз исследователя, уменьшается в 2 раза по сравнению с исходной. После включения осветителя микроскопа вначале добиваются максимально яркого освещения поля зрения путем вращения поляризатора или анализатора. Такое положение поляризационных фильтров соответствует совпадению их плоскостей поляризации. Препарат помещают на предметный столик и изучают его сначала в светлом поле. Затем путем вращения поляризатора (или анализатора) максимально затемняют поле зрения; эта позиция фильтра соответствует перпендикулярному расположению плоскостей поляризации. Для того чтобы выявить эффект анизотропии, нужно совместить плоскость поляризации анизотропного объекта с плоскостью поляризованного света. Эмпирически этого добиваются путем вращения предметного столика вокруг оптической оси. Если для поляризационной микроскопии используют световой микроскоп, не оборудованный вращающимся столиком, то приходится вращать гистологический препарат вручную. Это допустимо, однако в таком случае нельзя проводить отдельные виды поляризационной микроскопии, требующие количественной оценки (определение знака двоякого лучепреломления, величины разницы хода световых лучей).
Если анизотропные объекты в исследуемом препарате расположены упорядоченно (например, анизотропные диски поперечнополосатых мышечных волокон), их удобно изучать в фиксированном положении предметного столика, при котором эти объекты дают максимальное свечение на темном фоне. Если же анизотропные структуры располагаются в препарате хаотично (например, кристаллы), то при их исследовании приходится постоянно вращать предметный столик, добиваясь свечения той или иной группы объектов.
Для проведения более углубленного анализа и оценки топооптических реакций необходимо знать методику определения относительного знака двоякого лучепреломления, величины разницы хода лучей и индекса (коэффициента) лучепреломления.
Знак двоякого лучепреломления характеризует степень и направление смещения хода световых лучей, проходящих через анализатор. Это смещение вызывается топооптическими красителями, и в том случае, если оно направлено в сторону уменьшения разницы хода лучей, говорят об отрицательном знаке двоякого лучепреломления (отрицательная анизотропия), если же оно способствует увеличению разницы хода лучей, то констатируют положительный знак двоякого лучепреломления (положительная анизотропия). Если разница хода лучей исчезает, то эффект анизотропии нивелируется.
Знак двоякого лучепреломления определяют с помощью компенсатора. Процедура его применения заключается в следующем. Исследуемый объект помещают в положение, при котором в темном поле зрения достигается максимальное свечение анизотропных структур. Пластинку RI-компенсатора поворачивают вокруг оптической оси под углом +45° по отношению к плоскости поляризации анализатора. Объект в зависимости от разницы хода световых лучей, которая может колебаться от 20 до 200 нм, приобретает либо голубую, либо желтую окраску. В первом случае знак двоякого лучепреломления положительный, во втором — отрицательный. Следует иметь в виду, что в том случае, когда компенсатор расположен под углом +45°, общий фон затемненного поля зрения имеет красный оттенок.
Можно использовать также компенсатор λ/4 (U-TP137). Процедура его применения такая же, только поле зрения имеет не красный, а серый оттенок, и объект при положительном знаке лучепреломления светится, а при отрицательном — затемнен.
Количественное определение разницы хода световых лучей, выражаемой в нанометрах, осуществляют с помощью компенсатора Брака Келера. Для этого используют формулу:
Γ=Γλ×sinφ
где λ— константа, проставляемая на компенсаторе заводом-изготовителем, φ— угол поворота компенсатора относительно плоскости поляризации анализатора.
Индекс лучепреломления анизотропного объекта определяют путем его сопоставления (под микроскопом) с тест-объектом, помещаемым рядом. В качестве тест-объектов используют стандартные жидкости с известным индексом лучепреломления. Объект и образец помещают рядом на предметном столике. При несовпадении их коэффициентов преломления между объектом и образцом видна светлая линия, называемая линией Бека. Подъем тубуса микроскопа относительно сфокусированного положения вызывает смещение линии Бека в сторону среды, дающей более выраженный эффект лучепреломления. При совпадении коэффициентов лучепреломления объекта и образца линия Бека исчезает. Обычно коэффициент лучепреломления определяют в монохроматическом свете для натриевой линии спектра (при длине волны 589 нм и температуре 20 °С). Лучепреломление cледует определять для двух взаимно перпендикулярных плоскостей поляризации. С этой целью снимают анализатор и регистрируют лучепреломление объекта в его двух взаимно перпендикулярных положениях. Разница между обоими показателями лучепреломления (ng — nk) характеризует силу лучепреломления.
ОСОБЕННОСТИ ОБРАБОТКИ МАТЕРИАЛА И ПРИГОТОВЛЕНИЯ ПРЕПАРАТОВ
Фиксация материала для поляризационной микроскопии в кислом формалине нежелательна, так как формалиновый пигмент, образующийся при взаимодействии гемоглобина тканей с кислым формальдегидом, обладает анизотропными свойствами и затрудняет изучение препаратов в поляризованном свете. G. Scheuner и J. Hutschenreiter (1972) рекомендуют использовать с этой целью 10 % нейтральный формалин, раствор кальций-формола по Бейкеру, жидкость Карнуа.
Продолжительность фиксации в 10 % нейтральном формалине 24 — 72 ч при 4 °С, в растворе кальций-формола по Бейкеру — 16 — 24 ч при 4 °С. Фиксация в кальций-формоле особенно предпочтительна при исследовании липидно-белковых соединений. Жидкость Карнуа быстро пропитывает ткани. Кусочки толщиной 1 — 2 мм бывают профилированы уже через 1 ч при температуре 4 °С. Для исследования липидов фиксация в жидкости Карнуа непригодна. Кроме того, применяют жидкость Ценкера, особенно при импрегнации солями золота и серебра. После обработки смесью жидкости Ценкера и уксусной кислоты эритроциты приобретают способность к двоякому лучепреломлению.
При исследовании в поляризационном микроскопе плотных тканей (кости, зубы), помимо кислотной декальцинации, необходима дополнительная обработка для удаления коллагеновых волокон. С этой целью шлифы таких тканей в течение нескольких минут варят в смеси глицерина и гидроксида калия (10 мл глицерина и 2 крупинки гидроксида калия) до полного побеления, затем осторожно сливают щелочь, шлиф промывают в воде и переносят с помощью пинцета на предметный столик микроскопа.
Для поляризационной микроскопии используют парафиновые, замороженные и криостатные срезы. Неокрашенные замороженные срезы для изучения в поляризованном свете заключают в глицерин. Нефиксированные криостатные срезы пригодны для поляризационно-микроскопического анализа сразу после приготовления. В связи с их высокой чувствительностью к повреждающему действию различных факторов внешней среды эти срезы все же рекомендуют фиксировать в 10 % нейтральном формалине или растворе кальций-формола.
На результаты поляризационной микроскопии оказывает влияние толщина гистологических срезов. При исследовании толстых срезов создаются условия для наложения разных анизотропных структур друг на друга. Кроме того, при разной толщине срезов могут меняться анизотропные свойства изучаемых структур, поэтому очень важно, особенно при сравнительных исследованиях, обеспечивать постоянную толщину срезов. Рекомендуемая максимальная толщина срезов не должна превышать 10 мкм.
Еще одним обязательным условием является тщательное депарафинирование срезов, так как не удалённые остатки парафина дают выраженный эффект анизотропии, затрудняя исследование. Парафин особенно долго задерживается на эритроцитах и ядрах клеток. Для того чтобы полностью удалить парафин из срезов, рекомендуют провести их следующую обработку.
- Ксилол 30 мин
- Спирт 100% 5 мин
- Смесь метанола и хлороформа (1:1) при 50 °С 24 ч
- Спирт 100 % 5 мин
- Спирт 70 % 10 мин Вода
Следует также иметь в виду, что срезы, которые подвергают поляризационной микроскопии, не должны вступать в контакт с фенолами (например, их нельзя просветлять в карбол-ксилоле).
Более подробную информацию по поляризационной микроскопии и применении компенсаторов можно получить по ссылке (http://www.olympusmicro.com/primer/techniques/polarized/polarizedhome.html).
Если у Вас возникли вопросы по поляризационной микроскопии, обратитесь в Школу микроскопии.